Em função do grande número de associados da AAPI em busca de informações sobre a vacinação contra a febre amarela, a Diretoria de Saúde da entidade manteve contato com a Superintendência Regional de Saúde em busca da NOTA TÉCNICA 02/2017 assinada pelo Ministério da Saúde. O Portal AAPI publica as informações.
PROCEDIMENTOS
- Crianças entre 6 e 9 meses de idade
Em situação de suspeita de surto de febre amarela, epizootia em primatas não humanos ou confirmação da circulação viral em vetores silvestres, 1(uma) dose deve ser administrada aos 6 (seis) meses de idade, NÃO sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 9 (nove) meses e aos 4 (quatro) anos de idade. Observar o intervalo mínimo de 30 dias entre as doses.
- Pessoas a partir de 5 anos até 59 anos de idade:
– Que receberam uma dose da vacina antes de completar 5(cinco) anos de idade: Administrar um reforço, com intervalo mínimo de 30 dias entre as doses. – Que nunca foram vacinadas ou sem comprovante de vacinação: Administrar a primeira dose da vacina e 1(um) reforço após 10 (dez) anos. – Que possuem uma dose após 5 anos de idade: Fazer o reforço imediato, considerando dose válida (não é necessário aguardar o prazo de 10 anos da última dose). – Que receberam 2 (duas) doses da vacina: Considerar vacinado.
- Pessoas com 60 anos e mais:
– Que nunca foram vacinadas ou sem comprovante de vacinação: Se for residente em área de risco (zona rural), com ocorrência de epizootias e casos prováveis/confirmados de febre amarela, DEVEM receber uma dose com precaução e serem devidamente acompanhadas em relação aos eventos adversos. Obs: Esta regra é válida somente para primovacinados. Pessoas acima de 60 anos que já receberam uma dose da vacina anteriormente (em qualquer fase da vida) não precisam de avaliação criteriosa para receberem a segunda dose. – Que já possuem uma dose da vacina: Aplicar mais uma dose. – Que receberam 2 (duas) doses da vacina: Considerar vacinado.
- Gestantes:
– Se for residente em área de risco, com ocorrência de epizootias e casos prováveis/confirmados de febre amarela, a vacinação deverá ser analisada caso a caso através de avaliação médica e serem devidamente acompanhadas em relação aos eventos adversos durante todo o pré-natal e nascimento do bebê.
- Nutrizes ou lactantes:
– Em caso de mulheres que estejam amamentando crianças menores de 6 (seis) meses de idade deve ser evitada ou postergada. Na impossibilidade de adiar a vacinação, ou seja, aquelas residentes em área de risco, com ocorrência de epizootias e casos prováveis/confirmados de febre amarela a vacinação, deve-se apresentar a mãe opções para evitar o risco de transmissão do vírus vacinal pelo aleitamento materno, tais como: previamente à vacinação praticar a ordenha do leite e manter congelado por 28 dias, em freezer ou congelador, para planejamento do uso durante o período da viremia, ou seja, por 28 dias ou, pelo menos por 15 dias após a vacinação. Caso a ordenha não seja possível, encaminhar a mães à rede de banco de leite humano. – Para crianças acima de 6 meses, a mãe pode se vacinar normalmente e continuar a amamentação.

- Pessoas com imunodepressão:
Deverão ser avaliadas e vacinadas segundo orientações do Manual dos Centros de Referência para Imunobiológicos Especiais (CRIE). Disponível em: https://portal.fiocruz.br/sites/portal.fiocruz.br/files/documentos/manual-cries-9dez14-servico_vacinacao_ini.pdf
- Interação com outras vacinas
Em crianças menores de 2(dois) anos de idade não vacinadas contra a febre amarela, NÃO administrar as vacinas TRÍPLICE VIRAL ou TETRA VIRAL simultaneamente com a vacina febre amarela. O intervalo entre as vacinas é de 30 dias. Em situações de surto, este prazo pode ser reduzido para 15 dias.
PRECAUÇÕES GERAIS
Nos casos de doenças agudas febris moderadas ou graves recomenda-se adiar a vacinação até a resolução do quadro com o intuito de não se atribuir à vacina as manifestações da doença; – Indivíduos infectados pelo HIV, assintomáticos e com imunossupressão moderada, de acordo com a contagem de células CD4;
– Nutrizes ou lactantes amamentando crianças abaixo dos 6 meses de idade, a vacinação deve ser evitada, ou postergada até a criança completar 6 meses de idade.
– Na impossibilidade de adiar a vacinação, deve- se apresentar a mãe opções para evitar o risco de transmissão do vírus vacinal pelo aleitamento materno, tais como: previamente a vacinação praticar a ordenha do leite e manter congelado por 28 dias, em freezer ou congelador, para planejamento de uso durante o período da viremia, ou seja, por 28 dias OU, PELO MENOS POR 15 DIAS após a vacinação. Caso a ordenha não seja possível encaminhar a mãe à rede de banco de leite humano; – Primovacinação de indivíduos com 60 anos e mais;
– A administração da VFA em indivíduos com Lúpus Eritematoso Sistêmico ou com outras doenças de etiologia potencialmente autoimune deve ser avaliada caso-a-caso tendo em vista a possibilidade de imunossupressão;
– Pacientes que tenham desencadeado doença neurológica de natureza desmielinizante (SGB, ADEM e esclerose múltipla) no período de seis semanas após a aplicação de dose anterior da VFA. Tal recomendação se baseia em dados de literatura para a vacina Influenza;
– Pacientes transplantados de células tronco hematopoiéticas (medula óssea) devem ser avaliados caso a caso, considerando o risco epidemiológico. Caso se decida pela vacinação, deve ser respeitado o prazo mínimo de 24 meses após o transplante.
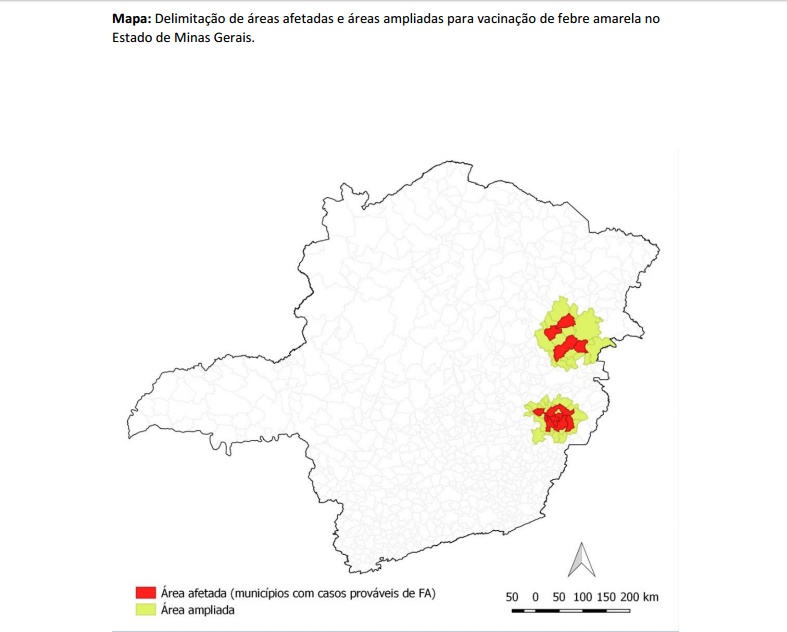
Veja na tabela a área ampliada para vacinação sem casos registrados da doença


CONTRA INDICAÇÕES
– Crianças menores de 6 meses de idade;
– Pacientes com imunodepressão de qualquer natureza:
– Pacientes infectados pelo HIV com imunossupressão grave, com a contagem de células CD4 < 200 células /mm3 ou menor de 15% do total de linfócitos para crianças menores de 6 anos;
– Pacientes em tratamento com drogas imunossupressoras (corticosteroides, quimioterapia, radioterapia, imunomoduladores);
– Pacientes submetidos a transplante de órgãos; – Pacientes com imunodeficiência primária;
– Pacientes com neoplasia; – Indivíduos com história de reação anafilática relacionada a substâncias presentes na vacina (ovo de galinha e seus derivados, gelatina bovina ou a outras);
– Pacientes com história pregressa de doenças do timo (miastenia gravis, timoma, casos de ausência de timo ou remoção cirúrgica);
Eventos adversos
A VFA (atenuada) é conhecidamente uma das vacinas mais eficazes e seguras, entretanto, eventos adversos graves e até fatais têm sido notificados e estão associados à disseminação do vírus vacinal.
Os EAPV podem ocorrer como reações locais e sistêmicas estas últimas variando de moderadas a graves inclusive com óbito.
Reações locais: a manifestação mais frequentemente referida é a dor no local de aplicação (4% em adultos, e um pouco menos em crianças pequenas), de curta duração (primeiro e segundo dias depois da aplicação), autolimitada e de intensidade leve ou moderada.
Manifestações sistêmicas gerais: febre, cefaleia e mialgia têm sido os eventos mais frequentemente relatados. A combinação dos três sintomas foi atribuível à VFA em aproximadamente 4% dos primovacinados e em menos de 2% dos indivíduos revacinados, nos 3 primeiros dias após a vacinação. A elevação limitada e reversível de enzimas hepáticas, sem manifestações clínicas, nas duas primeiras semanas após a vacinação foi relatada por alguns autores, porém a hipótese de que a VFA induz formas leves de dano hepático não foi confirmada em estudos posteriores.
Eventos adversos graves e VFA (EAG-VFA): incluem as reações de hipersensibilidade, doença neurológica aguda (encefalite, meningite, doenças autoimunes com envolvimento do sistema nervoso central e periférico) e doença viscerotrópica aguda (infecção multi-sistêmica generalizada, semelhante às formas graves da doença). No Brasil no período de 2007 a 2012, a incidência de EAG associados à vacina febre amarela foi de 0.42 casos por 100.000 doses administradas.
Reações de hipersensibilidade associada à VFA: anafilaxia e manifestações alérgicas são eventos raros e podem ocorrer como reação a qualquer um dos componentes da vacina. De acordo com a OMS em boletim epidemiológico publicado em 2008, a frequência estimada de reações tais como rash, urticária e asma, foi de 1 caso para 130.000 a 250.000 doses distribuídas e para as reações anafiláticas foi de 0.8 por 100.000 doses distribuídas. No Brasil, em estudos de póscomercialização a taxa de anafilaxia foi de 0.023 casos por 100.000 doses aplicadas, para o período de 1999 a 2009.
Ressalta-se que a frequência de notificações de eventos adversos associadas à VFA em campanhas de imunização tem sido maior do que na rotina, particularmente em áreas onde a vacina não era realizada anteriormente. É reconhecido que estas estratégias de vacinação em massa constituem situação potencialmente favorável ao aumento da percepção de risco em relação às vacinas podendo, também, existir aumento de erros de imunização (programáticos), devendo-se ser observado o protocolo de investigação diante de uma suspeita de um evento adverso grave e VFA.
Portanto, os EVENTOS ADVERSOS GRAVES OBSERVADOS APÓS A VACINAÇÃO DEVEM SER INFORMADOS E NOTIFICADOS IMEDIATAMENTE (EM ATÉ 24 HORAS).
Doses de vacinas contra a febre amarela entregues às regionais de saúde até segunda-feira (16/1):
– Governador Valadares: 145 mil
– Diamantina: 40 mil
– Manhumirim: 130 mil
– Teófilo Otoni: 252 mil
– Coronel Fabriciano: 290 mil
Assinam a nota técnica, Carla Magna Allan Santos Domingues (Coordenadora Geral do Programa Nacional de Imunizações) do Ministério da Saúde e Rodrigo Fabiano do Carmo Said (Subsecretário de Vigilância e Proteção à Saúde) da Secretaria Estadual de Saúde de Minas Gerais.
Foto – Crédito: Agência EBC


Deixe um comentário